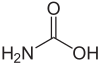
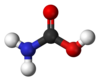
胺甲酸
| 胺甲酸 | |||
|---|---|---|---|
| |||
| IUPAC名 Carbamic acid[1] | |||
| 別名 | 胺基甲酸 | ||
| 識別 | |||
| CAS號 | 463-77-4 | ||
| PubChem | 277 | ||
| ChemSpider | 271 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | KXDHJXZQYSOELW-UHFFFAOYAC | ||
| ChEBI | 28616 | ||
| DrugBank | DB04261 | ||
| KEGG | C01563 | ||
| MeSH | Carbamic+acid | ||
| 性質 | |||
| 化學式 | CH3NO2 | ||
| 莫耳質量 | 61.04 g·mol−1 | ||
| 相關物質 | |||
| 相關化學品 | 甲醯胺 二硫代胺基甲酸酯 碳酸 尿素 胺基甲酸乙酯 甘胺酸 | ||
| 若非註明,所有資料均出自標準狀態(25 ℃,100 kPa)下。 | |||
胺甲酸也稱為胺基甲酸,化學式是NH2COOH,可看做是甲酸上的一個氫被胺基取代。有許多胺甲酸的衍生物,多半都是不穩定的,會轉換為胺類及二氧化碳[2]胺甲酸的酯為胺基甲酸酯。
胺基甲酸可以由氨 NH3和二氧化碳 CO2在非常低的溫度下反應而成,反應也會產生等量的胺基甲酸銨。胺基甲酸在250 K (−23 °C)以上不穩定,會分解成氨和二氧化碳。[3]胺基甲酸固體以二聚體存在,兩個分子間的羧基 -COOH以氫鍵產生偶合。[4]
胺甲酸同時有胺基和羧基,因此是一種胺基酸。[3] 不過,由於它的氮原子直接和羧基連接(沒有碳鏈分開),使得它和其它胺基酸的性質非常不同。甘胺酸通常被認為是最簡單的胺基酸。碳原子中有連接羥基,也把胺甲酸從醯胺類排除。
結構[編輯]
胺基甲酸的H2N–基團和其它胺不同,不能被質子化成銨基 H3N+–。它的兩性離子形式 H3N+–COO−非常不穩定,會立刻分解成二氧化碳和氨氣。[6]然而,有報導稱在用高能質子輻照的冰中檢測到了這種兩性離子。[3]
用途[編輯]
胺甲酸是制備尿素中的中間產物,是氨和二氧化碳反應時產生的[7]
- CO2 + NH3 → H2N-CO2H
- H2N-CO2H + NH3 → CO(NH2)2 + H2O
胺甲酸轉移酶(Carbamoyltransferases)屬於轉移酶,EC編號 2.1.3。
參見[編輯]
參考文獻[編輯]
- ^ International Union of Pure and Applied Chemistry. Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. 2014: 778. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069.
- ^ Thomas L. Lemke. Review of organic functional groups : introduction to medicinal organic chemistry. Philadelphia, Pa.: Lippincott Williams & Wilkins. 2003: 63. ISBN 978-0-7817-4381-5.
- ^ 3.0 3.1 3.2 3.3 R. K. Khanna and M. H. Moore (1999): "Carbamic acid: molecular structure and IR spectra". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, volume 55, issue 5, pages 961-967. doi:10.1016/S1386-1425(98)00228-5 PMID 10347902Bibcode:1999AcSpA..55..961K
- ^ J. B. Bossa, P. Theulé, F. Duvernay, F. Borget and T. Chiavassa (2008): "Carbamic acid and carbamate formation in NH3:CO2 ices – UV irradiation versus thermal processes". Astronomy and Astrophysics, volume 492, issue 3, pages 719-724. doi:10.1051/0004-6361:200810536
- ^ R.K. Khanna; M.H. Moore. A 55. Carbamic acid: molecular structure and IR spectra (pii: S1386-1425(98)00228-5) (PDF). Greenbelt, MD.: Elsevier. 1998: 961–967 [2017-07-02]. (原始內容 (PDF)存檔於2017-08-09).
- ^ Y.-J. Chen, M. Nuevo, J.-M. Hsieh, T.-S. Yih, W.-H. Sun, W.-H. Ip, H.-S. Fung, S.-Y. Chiang, Y.-Y. Lee, J.-M. Chen and C.-Y. R. Wu (2007): "Carbamic acid produced by the UV/EUV irradiation of interstellar ice analogs". Astronomy and Astrophysics, volume 464, issue 1, pages 253-257. doi:10.1051/0004-6361:20066631
- ^ Meessen, J. H.; Petersen, H., Urea, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a27_333