本特規則

在化學中,本特法則(英語:Bent's rule)描述並解釋了分子的中心原子的軌道雜化與取代基的電負性之間的關係。[1][2] 亨利·A·本特發表的規則如下:[2]
原子雜化軌道中,指向電正性取代基的雜化軌道帶有較強的s軌道特徵
分子的化學結構與其性質和反應性密切相關。價鍵理論提出分子結構是由原子之間的共價鍵連接決定的,每條鍵由兩個通常軌道雜化而成的原子軌道重疊而成。傳統上,p區元素元素被假定為採取嚴格的spn方式,其中 n 是 1、2 或 3。其中,每條雜化軌道被假定為等價的。這種方法通常能給出較好的預測和解釋,但在解釋雜化軌道中所含s成分和p成分的比例不完全相等的不等性雜化時,需要改進。本特規則提供了關於如何構建這些雜化軌道的定性估計。[3]
本特規則指的是,在分子中與多個取代基鍵合的中心原子會發生雜化,其中指向電正性取代基的雜化軌道具有更多的s軌道的特徵,而指向電負性取代基的雜化軌道具有更多的p特徵的軌道。這樣可以更好地預測和解釋分子結構和鍵強度等性質。[4]比如對於水分子而言,其中氧原子的孤對電子可視作連接電正性最大的取代基,其雜化軌道為sp2.3,含有約30%的s軌道和約70%的p軌道。而連接氫原子的成鍵電子對為~sp4.0,含有約20%的s軌道和約80%的p軌道。最近檢查了Bent規則對主族元素之間七十五種鍵類型的有效性。[5]
應用
[編輯]本特規則可以被用於解釋分子結構和反應性。
鍵角
[編輯]雜化軌道理論解釋了為什麼甲烷是正四面體結構而乙烯是平面結構,但對於偏移理想結構鍵角的氨分子和水分子,一般採用VSEPR理論的解釋,即孤電子對之間的排斥要大於成鍵電子對之間的排斥。本特規則提出了另一種解釋。首先考慮甲烷、乙烯和乙炔的鍵角,三者中碳的雜化方式分別是sp3、sp2和sp雜化,對應的鍵角為約109.5°, 約120°and 180°。可見當雜化軌道中含有較高比例的p軌道時,會造成較小的鍵角。This result can be made rigorous and quantitative as Coulson's theorem (see Formal theory section below).

本特利用p軌道的比例和鍵角的關係,比較了下列分子的鍵角。考慮到甲基的電負性<H<F,連接甲基的雜化軌道中s軌道的比例應該最多,所以下面分子的鍵角應該是遞減的,這與實驗結果一致[2]
| 分子種類 | 取代基之間鍵角 |
|---|---|
二甲醚 |
111° |
甲醇 |
107-109° |
水 |
104.5° |
二氟化氧 |
103.8° |
本特規則認為孤電子對相當於連着很高電正性的取代基。所以對於水分子,孤電子對含有較高比例的s軌道,而連着氫的雜化軌道含有較高比例的p軌道,於是成鍵電子對之間的鍵角較小。氨分子的情況類似,其連着氫的雜化軌道的形式為(~sp3.4,約含23% s軌道,而孤電子對為~sp2.1含有大概32%的s。造成氨分子的鍵角為107.0。因此可以預測NH3的鍵角大於NF3的鍵角,這與VSEPR理論的預測相反,但與實測一致。[6]
鍵長
[編輯]與鍵角類似,鍵長與成鍵原子的雜化軌道有關,s軌道的比例越高,鍵長越短。[2]
| 分子種類 | 平均碳-碳鍵長 |
|---|---|
 |
1.54 Å |
 |
1.50 Å |
 |
1.46 Å |
從下圖中可以看出,當高電負性的F原子不斷取代氫原子時,C-F鍵的雜化軌道中s的比例在增加,p軌道的比例在降低,所以鍵長逐漸變短。
| 分子種類 | 平均碳-氟鍵長 |
|---|---|
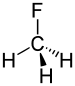 一氟甲烷 |
1.388 Å |
 二氟甲烷 |
1.358 Å |
 三氟甲烷 |
1.329 Å |
 四氟甲烷 |
1.323 Å |
同樣的趨勢也可以鑑於甲烷的四種氯代物。但由於氯的電負性要小於氟,鍵長差別變得比較小[2]
| 分子種類 | 平均碳-氯鍵長 |
|---|---|
 一氯甲烷 |
1.783 Å |
 二氯甲烷 |
1.772 Å |
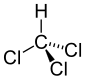 三氯甲烷 |
1.767 Å |
 四氯甲烷 |
1.766 Å |
誘導效應
[編輯]本特規則也可以解釋誘導效應。[7]誘導效應指的是部分電荷可以沿着相連的共價單鍵進行傳遞,比如當連在中心碳原子上的官能團變得電負性更高時,中心碳原子會變得更加拉電子。本特規則認為,當官能團的電負性增大時,官能團和中心碳原子之間的雜化軌道中p軌道的比例較高,造成了中心碳原子和烴基之間的雜化軌道s軌道的比例較高。因為s軌道比p軌道更接近原子核,所以烴基上的電子云密度更接近於中心碳原子。 這使得中心碳原子更顯示出拉電子的誘導效應[8] [9]
| Substituent | 極性取代基常數 (較大值表示較強的拉電子能力) |
|---|---|
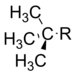 叔丁基 |
−0.30 |
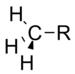 甲基 |
0.00 |
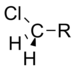 氯甲基 |
1.05 |
 二氯甲基 |
1.94 |
 三氯甲基 |
2.65 |
參考文獻
[編輯]- ^ Weinhold, F.; Landis, C. L., Valency and Bonding: A Natural Donor-Acceptor Perspective 1st, Cambridge: Cambridge University Press, 2005, ISBN 978-0-521-83128-4
- ^ 2.0 2.1 2.2 2.3 2.4 Bent, H. A., An appraisal of valence-bond structures and hybridization in compounds of the first-row elements, Chem. Rev., 1961, 61 (3): 275–311, doi:10.1021/cr60211a005
- ^ Foster, J. P.; Weinhold, F., Natural hybrid orbitals, J. Am. Chem. Soc., 1980, 102 (24): 7211–7218, doi:10.1021/ja00544a007
- ^ Alabugin, I. V.; Bresch, S.; Gomes, G. P. Orbital Hybridization: a Key Electronic Factor in Control of Structure and Reactivity. J. Phys. Org. Chem. 2015, 28 (2): 147–162. doi:10.1002/poc.3382.
- ^ Alabugin, I. V.; Bresch, S.; Manoharan, M. Hybridization Trends for Main Group Elements and Expanding the Bent's Rule Beyond Carbon: More than Electronegativity. J. Phys. Chem. A. 2014, 118 (20): 3663–3677. Bibcode:2014JPCA..118.3663A. PMID 24773162. doi:10.1021/jp502472u
 .
.
- ^ Weinhold, F.; Landis, Clark R. Discovering Chemistry with Natural Bond Orbitals. Hoboken, N.J.: Wiley. 2012: 67–68. ISBN 9781118119969.
- ^ Bent, H. A., Distribution of atomic s character in molecules and its chemical implications, J. Chem. Educ., 1960, 37 (12): 616–624, Bibcode:1960JChEd..37..616B, doi:10.1021/ed037p616
- ^ 引用錯誤:沒有為名為
Walsh的參考文獻提供內容 - ^ Taft Jr., R. W., Concerning the Electron—Withdrawing Power and Electronegativity of Groups, J. Chem. Phys., 1957, 26 (1): 93–96, Bibcode:1957JChPh..26...93T, doi:10.1063/1.1743270
