朱利亚烯烃合成
朱利亚烯烃合成(英語:Julia olefination,另稱朱利亞烯化反应)是苯基砜与醛或酮作用并官能团化生成酯,然后在还原剂(如钠汞齐[1][2]、二碘化钐[3])作用下发生还原消除生成烯烃的反应。[4][5] 反应的主要产物是反式烯烃。此反應由法國化學家馬克·朱利亞(法語:Marc Julia)首先發現,故得其名。
該反应操作简便,四步都可以在一锅中反应,立体选择性较好。中间体2也可分离出来,经纯化后,再经还原消除或其他方法生成烯烃,使产率提高。
往往需要将醛与砜加成得到的醇官能团化,将其与乙酸酐、苯甲酰氯等试剂反应,转化为乙酸酯、苯甲酸酯、对甲苯磺酸酯或甲磺酸酯的形式,以提高消除反应的产率,并避免逆羟醛反应发生。
反应机理
[编辑]砜的α-氢具有酸性,在强碱(如正丁基锂、叔丁基锂、甲基锂、二异丙基氨基锂)的作用下失去,得到负离子2,与醛发生加成,生成负离子中间体3。接着3与R3-X反应成酯,经钠汞齐在极性质子溶剂(如甲醇、乙醇)中还原消除,经过自由基机理,生成烯烃6。
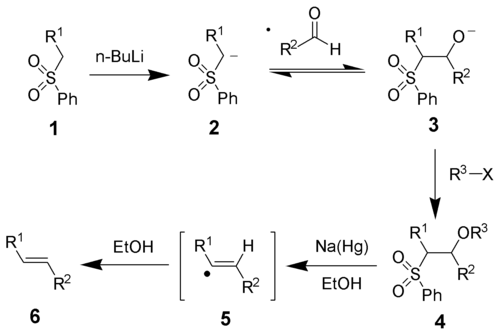
还原消除一步的详细机理还不是很明确,以前认为是下图中的第一个机理,但1995年时Keck等人发现,如果反应在氘代溶剂中进行,则砜的α-氢几乎被完全氘代,与原来假设的机理不符,故提出了一个新的机理(下图中的第二个机理)。烯烃的立体化学与中间体4无关,无论是苏式还是赤式的反应物经过反应后,都得到反式烯烃。这可能是由于还原时生成的烯基自由基可以自由旋转,从而偏向于热力学稳定产物的缘故。若用二碘化钐作还原剂,反应的立体选择性(E/Z值)明显下降,而且没有上述的氘代现象发生。Keck等人认为其原因是砜基离去后,生成的碳负离子不够稳定,很快就发生消除生成烯烃,而没有时间达到平衡的缘故。[3]

杂环芳香化合物
[编辑]
当把原料中的苯基砜换为杂环芳基砜时,反应机理会发生很大变化。[6] 以常见的苯并噻唑基砜为例,[7] 砜被去质子化,然后与醛发生加成生成负离子2。之后2发生Smiles重排反应,[8] 经过加成-消除两步后,与芳环相连的原子变为氧,涉及的不稳定中间体很快放出二氧化硫,生成羟基苯并噻唑锂盐和烯烃。由于反应不再涉及可以发生平衡反应的中间体(如碳负离子),故烯烃的立体化学由砜负离子与醛加成一步的立体选择性所决定,一般都是立体异构体的混合物。
朱利亞-科森斯基烯烴合成
[编辑]
當发生朱利亞反应的砜为四唑基砜时,反应与上面苯并噻唑基砜的机理相同,称为朱利亞-科森斯基烯烴合成,示例如下。[9][10]
参见
[编辑]参考资料
[编辑]- ^ Julia, M.; Paris, J.-M. Tetrahedron Lett. 1973, 14, 4833-4836. doi:10.1016/S0040-4039(01)87348-2
- ^ Kocienski, P. J.; Lythgoe, B.; Ruston, S. J. Chem. Soc., Perkin Trans. 1 1978, 829.
- ^ 3.0 3.1 Keck, G. E.; Savin, K. A.; Weglarz, M. A. J. Org. Chem. 1995, 60, 3194-3204. doi:10.1021/jo00115a041
- ^ Kocienski, P. J. Phosphorus and Sulfur 1985, 24, 97-127.(综述)
- ^ Kelly, S. E. Comp. Org. Syn. 1991, 1, 792-806.(综述)
- ^ Blakemore, P. R. J. Chem. Soc., Perkin Trans. 1 2002, 2563–2585. (综述)
- ^ Baudin, J. B.; Hareau, G.; Julia, S. A.; Ruel, O. Tetrahedron Lett. 1991, 32, 1175. doi:10.1016/S0040-4039(00)92037-9
- ^ Truce, W. E.; Kreider, E. M.; Brand, W. W. Org. React. 1970, 18, 99.(综述)
- ^ Paul R. Blakemore, William J. Cole, Philip J. Kocieński, Andrew Morley Synlett 1998, 26-28. doi:10.1055/s-1998-1570
- ^ Christophe Aïssa J. Org. Chem. 2006, 71, 360 - 363. doi:10.1021/jo051693a
