碳正离子

碳正離子,又稱作碳陽離子,是一個帶有正電的碳原子,其中最簡單的形式為甲基碳正離子CH3+,跟乙基碳陽離子C2H5+。有些碳正離子基會帶有兩個或更多的正電,正電可能會在同一個或是不同的碳上,如乙烯雙陽離子基C2H42+。
直到1970年代早期,碳陽離子都被視為碳離子。在近代的化學中,帶正電的碳原子就視作一個碳陽離子。根據碳原子的價數可以分成兩大類:三價的碳離子(質子化的碳烯),或五到六價的碳離子(質子化的烷類),而命名法為乔治·安德鲁·欧拉(George A. Olah)所發表,碳正離子能藉由分散或离域正電荷來達到穩定。
歷史
[编辑]碳陽離子的歷史可追溯到1891年,G. Merling說他將溴加到環庚三烯(cycloheptatriene)上,然後加熱結晶化產物取得水溶性物質C7H7Br,產生一個他無法解釋的結構。然而, Doering 跟Knox預測是符合Hückel's 規則的溴化環庚三烯的芳香族來解釋這個現象。
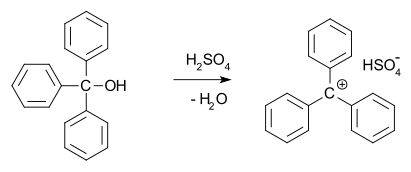
1902年,Norris 跟Kehrman分別發現無色的三苯基甲醇(triphenylmethanol)在濃硫酸中會變成深黃色。相似地,三苯基氯甲烷(Triphenylmethyl chloride)會跟鋁、錫氯化物形成有機複合物。同年,阿道夫·冯·拜尔 (Adolf von Baeyer)認為其化合物形成一個類似鹽類的構造。阿道夫猜測顏色跟鹽類結構之間的關係就好比孔雀石綠(malachite green)。
碳陽離子在許多有機反應中扮演中間物的角色。其概念最早由Julius Stieglitz於1899年發表,Hans Meerweiny在他於1922做的研究Wagner-Meerwein rearrangement(重組)對其概念有更深的發展。且碳正離子在SN1,E1及重組反應(如Whitmore 1,2 轉移)中被發現有參與反應進行。很長的一段時間,美國的化學家不願意去接受一個新的化學概念,在文章中也不去提到碳正離子此概念。
第一個溶液中穩定的碳正離子的NMR圖譜在1958由Doering等人所發表。其為七甲基苯離子(heptamethylbenzenium ion),由六甲基苯加上氯化鋁、氯甲烷所製成。Story等人於1960製備出穩定的7-norbornadienyl 陽離子,藉由norbornadienyl chloride與-80℃下溶於液態二氧化硫的四氟硼酸銀(Silver tetrafluoroborate)反應產生。此NMR圖譜顯示出一個非傳統的中間物(第一個發現的非傳統穩定離子)
1962年,Olah藉由核磁共振直接發現三級丁基碳陽離子跟溶於魔酸(magic acid)裡的三級丁基氟一樣穩定。Norbornyl陽離子的NMR圖譜最先由 Schleyer等人發表,而Saunders等人則顯示出屏障間質子搶奪的過程。
結構與特性
[编辑]碳陽離子中帶有電荷的碳原子為六價態(sixtet),即外層電子只有六顆,而非符合八隅體的八顆。因此碳陽離子反應性高,以轉變成有八顆電子的碳原子。其軌域為sp2混成軌域跟一個空的p軌域,而非sp3杂化,其中一個帶有正電。分子模型為平面三角形。簡單的例子如CH3+ 。而碳正離子常作為親電體,像氫氧離子、鹵素離子的結合對象。
碳正離子通常會進行重組反應,以反應常數超過109 /秒的速度從較不穩定的結構轉變到較穩定的結構。此現象讓許多化合物的合成過程變得複雜。例如:將3-戊醇跟HCl水溶液共熱產生3-戊基碳正離子,會因重組反應產生3-戊基跟2-戊基的混和物。再跟氯離子進行反應得到的產物會有約1/3的3-氯戊烷跟2/3的2-氯戊烷。
碳正離子能藉由與相鄰的碳-碳雙鍵共振來達到穩定。像是烯丙基陽離子(allyl cation)跟苄基陽離子(benzylic cation)就相較於其他碳正離子更加穩定。能夠形成烯丙基或苯基碳正離子的分子其反應性就會較佳。經由與碳正離子空的p軌域與鄰近的π鍵重疊,C+能夠有額外的穩定性。軌域的重疊能夠讓複數的原子分享電荷,同時穩定碳陽離子。另一個穩定碳陽離子的因素是超共軛(Hyperconjugation),空的p軌域接受鄰近碳上的電子對來將正電轉給對方。
參考資料
[编辑]- Hansjörg Grützmacher, Christina M. Marchand (1997), "Heteroatom stabilized carbenium ions", Coordination Chemistry Reviews, volume 163, pages 287-344
- George A. Olah (1972), "Stable carbocations. CXVIII. General concept and structure of carbocations based on differentiation of trivalent (classical) carbenium ions from three-center bound penta- of tetracoordinated (nonclassical) carbonium ions. Role of carbocations in electrophilic reactions." Journal of the American Chemical Society, volume 94, issue 3, pages 808–820
- Organic chemistry 5th Ed. John McMurry ISBN 0-534-37617-7
- Organic Chemistry, Fourth Edition Paula Yurkanis Bruice ISBN 0-13-140748-1
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (1st ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- Organic Chemistry by Marye Anne Fox and James K. Whitesell ISBN 0-7637-0413-X
- The Cycloheptatrienylium (Tropylium) Ion W. Von E. Doering and L. H. Knox J. Am. Chem. Soc.; 1954; 76(12) pp 3203 - 3206
- On the Constitution of the Salts of Imido-Ethers and other Carbimide Derivatives; Am. Chem. J. 21, 101
- Rzepa, H. S.; Allan, C. S. M. (2010). "Racemization of Isobornyl Chloride via Carbocations: A Nonclassical Look at a Classic Mechanism". Journal of Chemical Education 87 (2)
- The 1,1,2,3,4,5,6-heptamethylbenzenonium ion W. von E. Doering and M. Saunders H. G. Boyton, H. W. Earhart, E. F. Wadley and W. R. Edwards G. Laber Tetrahedron Volume 4, Issues 1-2 , 1958, Pages 178-185
- The 7-norbornadienyl carbonium ion Paul R. Story and Martin Saunders J. Am. Chem. Soc.; 1960; 82(23) pp 6199 - 6199
- George A. Olah - Nobel Lecture
- Stable Carbonium Ions. XVII.1a Cyclopropyl Carbonium Ions and Protonated Cyclopropyl Ketones Charles U. Pittman Jr., George A. Olah J. Am. Chem. Soc., 1965, 87 (22), pp 5123–5132
參見
[编辑]
