氢键

 氫鍵是分子間作用力的一種,是一种永久偶极之间的作用力,氢键发生在已经以共价键与其它原子键结合的氢原子与另一个原子之间(X-H…Y),通常发生氢键作用的氢原子两边的原子(X、Y)都是电负性较强的原子。氢键既可以是分子间氢键,也可以是分子内的[1]。其键能最大约为200kJ/mol,一般为5-30kJ/mol,比一般的共价键、离子键和金属键键能要小,但强于静电引力。
氫鍵是分子間作用力的一種,是一种永久偶极之间的作用力,氢键发生在已经以共价键与其它原子键结合的氢原子与另一个原子之间(X-H…Y),通常发生氢键作用的氢原子两边的原子(X、Y)都是电负性较强的原子。氢键既可以是分子间氢键,也可以是分子内的[1]。其键能最大约为200kJ/mol,一般为5-30kJ/mol,比一般的共价键、离子键和金属键键能要小,但强于静电引力。
氢键对于生物高分子具有尤其重要的意义,它是蛋白质和核酸的二、三和四级结构得以稳定的部分原因。
成键
[编辑]氢键通常可用X-H…Y來表示。其中X以共价键与氢相连,具有较高的电负性,可以稳定负电荷,因此氢易解离,具有酸性(质子给予体)。而Y则具有较高的电子密度,一般是含有孤电子对的原子,容易吸引氢原子,从而与X和H原子形成三中心四电子键。
键能
[编辑]氢键键能大多在25-40kJ/mol之间。一般认为键能小於25kJ/mol的氢键属于较弱氢键,键能在25-40kJ/mol的属于中等强度氢键,而键能大於40kJ/mol的氢键则是较强氢键。[2] 曾经有一度认为最强的氢键是[HF2]−中的FH…F−键,计算出的键能大约为169kJ/mol。[3] 而事实上,用相同方法计算甲酸和氟离子间的[HCO2H…F−]氢键键能,结果要比HF2−的高出大约30kJ/mol。[4]
| 较弱 | 中等 | 较强 | |||
|---|---|---|---|---|---|
| HSH…SH2 NCH…NCH H2NH…NH3 MeOH…OHMe HOH…OH2 |
7 16 17 19 22 |
FH…FH ClH…OMe2 FH…OH2 |
29 30 38 |
HOH…Cl− HCONH2…OCHNH2 HCOOH…OCHOH HOH…F− H2OH+…OH2 FH…F− HCO2H…F− |
55 59 59 98 151 169 ~200 |
常见氢键的平均键能数据为:
- F—H :F (155 kJ/mol 或 40 kcal/mol)
- O—H :N (29 kJ/mol 或 6.9 kcal/mol)
- O—H :O (21 kJ/mol 或 5.0 kcal/mol)
- N—H :N (13 kJ/mol 或 3.1 kcal/mol)
- N—H :O (8 kJ/mol 或 1.9 kcal/mol)
- HO—H :OH3+ (18 kJ/mol[5] 或 4.3 kcal/mol)
成键原子
[编辑]典型的氢键中,X和Y是电负性很强的F、N和O原子。但C、S、Cl、P甚至Br和I原子在某些情况下也能形成氢键[2],但通常键能较低。
碳在与数个电负性强的原子相连时也有可能产生氢键。例如在氯仿CHCl3中,碳原子直接与三个氯原子相连,氯原子周围电子云密度较大,因而氢原子周围即带有部分正电荷,碳也因此参与了氢键的形成,扮演了质子供体的角色。
芳香环、碳碳三键或双键在某些情况下都可作为电子供体,与强极性的X-H(如-O-H)形成氢键。
方向
[编辑]X-H…Y往往不是严格的直线。[6] 哪怕不算分叉的氢键,一对一的氢键中也有很多键角处在150°-180°之间的情况,氟化氢长链中的氢键即是一例。[2]
对称氢键
[编辑]通常氢是通过共价键与X原子相连,并通过较长和较弱的“氢链”与Y原子连接,即使X与Y是相同的元素,X-H和H…Y距离也往往不相等。但在M+HA2−型的酸式盐中,其中A是F−或某些有机酸(如乙酸和苯甲酸),氢原子恰好处于X和Y原子的中心(X-H…Y)。这一类例子被称作对称氢键,它们往往键能较大,键长较短。[7]
对称氢键和不对称氢键的现象往往难以解释。一个比较认同的解释是,将FHF−离子中的氢键看成氢桥,类似于乙硼烷中的BHB硼桥键。只不过硼桥键是三中心两电子键,而氢桥键是三中心四电子键。[7]
双氢键
[编辑]1995年以来,报道了许多种分子间存在一种被称为双氢键的新型分子间力,可用通式AH…HB表示。[8] 双氢键的键长一般小于220pm,极限可能为270pm,键能从n~n*10kJ/mol不等,相当于传统分子间力能量数量级。双氢键的一些例子包括:BH4−…HCN、BH4−…CH4、LiH…NH4、LiH…HCN、LiH…HC≡CH,CH4…H-NH3+和H-Be-H…H-NH3等,其中以BH4−…HCN双氢键的键长为最短(171pm),键能也最高(75.44kJ/mol),远大于水和HF间的氢键键能。目前对双氢键的研究还不是很深入。
分子間氫鍵
[编辑]
- 醇、酚、羧酸、胺、醯胺、醣類均常有。
- 常形成二聚體或聚合物,尤其在低極性溶液或蒸氣狀態時。例如:乙酸二聚體、氟化氫鏈狀聚合物與環狀六聚體。
- 常形成空洞結構降低固態密度。例如:冰中每個水分子都按四面體方向參與4個O-H…O氫鍵,平均每分子二氫鍵,鍵能18.8kJ/mol。水分子在晶體結構中空間占有率較低,存在六邊形空洞,故冰的密度較小。熔化時破壞部分氫鍵,熔化熱5.0kJ/mol,故剛熔化的水中仍有大量的氫鍵,並隨溫度增高更多氫鍵斷裂,使密度增大。在4℃時,受熱使分子間距增大造成密度減小的趨勢與受熱使氫鍵斷裂造成密度增加的趨勢相等,因此此時水密度最大。這個溫度對於水中生物至關重要,它保證了冬季時水中生物不至於因為水結冰而死亡。
- 常增加表面張力,分子間氫鍵形成彈性薄膜。例如水。
- 常增加比熱,因為受熱時氫鍵吸收能量斷裂。例如水。
- 常增加莫耳汽化熱與沸點,因汽化須破壞氫鍵。例如:
- PH3<AsH3<NH3<SbH3<BiH3,NH3有氫鍵故沸點上升(惟氫鍵較弱),其餘依分子量。
- H2S<H2Se<H2Te<H2O,H2O有氫鍵故沸點上升,其餘依分子量。
- HCl<HBr<HI<HF,HF有氫鍵故沸點上升,其餘依分子量。
- 常增加莫耳熔化熱與熔點,但增加量常較沸點小,因為熔化僅須打破部分氫鍵以破壞晶格。另外,熔點受晶體堆積方式等影響,較難以預測。
- 常增加在極性溶劑中的溶解度(同類互溶),尤其在也有氫鍵的溶劑中,因為溶質與溶劑間氫鍵與偶極-偶極力。例如:氨、氟化氫在水中的高溶解度。
- 結晶水合物中存在由氫鍵構建的類冰骨架,其中可裝入小分子或離子。例如:甲烷水合物。
分子內氫鍵
[编辑]- 通常,形成分子內氫鍵後,須圍成五、六或七員環,才是穩定的結構,故分子內氫鍵多發生於順式或鄰位。如順丁烯二酸、鄰苯二酚、鄰羥基苯甲醛(水楊醛)、鄰羥基苯甲酸(水楊酸)。
- 常使酸性增強,因為分子內氫鍵促進了未參與氫鍵的氫自氫鍵的受體上解離。例如:苯甲酸的pKa=11.02;鄰羥基苯甲酸(水楊酸)可形成一個分子內氫鍵,pKa=11;2,6-二羥基苯甲酸(γ-間羥基苯甲酸)可形成兩個分子內氫鍵,pKa=8.3。
- 常使熔沸點降低,因與其他分子間作用力減小。例如:鄰苯二酚、鄰氯苯酚、鄰硝基苯酚的沸點均較間位與對位者低。
- 加熱時常被破壞。
- 常增加耐酸鹼性,因質子化或去質子化須破壞分子內氫鍵。
- 可能造成一種異構物優於另一種。例如:反丁烯二酸較具有分子內氫鍵的順丁烯二酸位能更低而更穩定、2,4-戊二酮的烯醇形式(有分子內氫鍵)與酮形式(無分子內氫鍵)分別在氣相與極性液體中更優。[來源請求]
- 常增加在極性溶劑中的溶解度,尤其也有氫鍵的溶劑,因為:
- 常增加黏度。例如:甘油(丙三醇)和硫酸有較高的黏度、丙三醇黏度>乙二醇黏度>乙醇黏度。
- 常見於,羥基的H,與苯環上鄰位,或順式鏈(包含無分順反的鏈)同側上(包含無分側之可旋轉單鍵上)的羰基(包含酮基、羧基、醛基等中的羰基)、硝基或另一羥基的O,或鹵取代基(通常是氟),形成氫鍵。例如:順丁烯二酸(順式羧基H-羧基O)、2-羥基苯甲酸(鄰位羥基H-羧基O)、2-羥基苯甲醛(鄰位羥基H-醛基O)、2-氟苯甲酸(鄰位羧基H-氟取代基)、1,2-苯二酚(鄰位羥基H-羥基O)、2-硝基苯酚(鄰位羥基H-硝基N)、丙二酸(可旋轉鏈羧基H-羧基O)、2-羥基苯乙酮(鄰位羥基H-酮基O)。
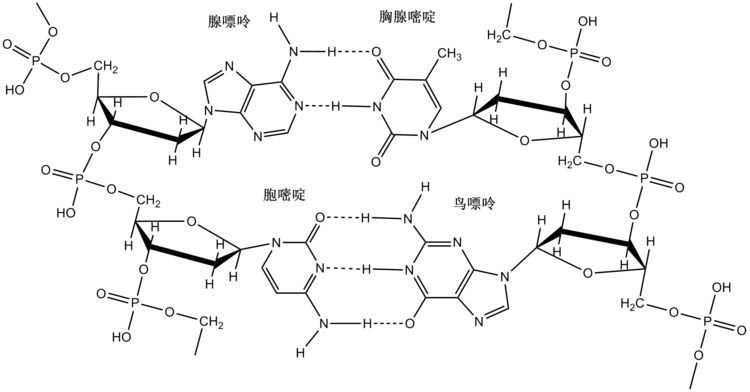
- 常形成聚合物,並常為螺旋狀。例如:C=O…H-N氫鍵使蛋白質形成α螺旋、DNA或RNA的兩條鏈的含氮鹼基通過氫鍵配對,而氫鍵的飽和性和方向性使得雙螺旋的鹼基配對具有專一性,即A-T靠2個氫鍵配對而C-G靠3個氫鍵配對。
参见
[编辑]参考资料
[编辑]- ^ International Union of Pure and Applied Chemistry. "hydrogen bond (页面存档备份,存于互联网档案馆)". Compendium of Chemical Terminology Internet edition.
- ^ 2.0 2.1 2.2 2.3 Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Ed., Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ 对于这个数据有争议,一般在150-250kJ/mol之间。不少人认为155kJ/mol较恰当,参见 Emsley, J. (1980). "Very Strong Hydrogen Bonds". Chemical Society Reviews 9: 91-124. 离子回旋共振谱法得出的数据为163±4kJ/mol,参看 J. Emsley, Polyhedron 4, 489-90 (1985).也与之吻合较好。
- ^ J. Emsley, O. P. A. Hoyte and R. E. Overill, J. Chem. Soc., Chem. Commun., 225 (1977).
- ^ Omer Markovitch and Noam Agmon (2007). "Structure and energetics of the hydronium hydration shells". J. Phys. Chem. A 111 (12): 2253 - 2256. doi:10.1021/jp068960g.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, and Manfred Bochmann, Advanced Inorganic Chemistry, 6th ed.. Wiley-Interscience. ISBN 0-471-19957-5.
- ^ 7.0 7.1 张青莲等。《无机化学丛书》第一卷。北京:科学出版社。
- ^ Chem. Commun., 1996, 14: 1633.
- ^ PubChem. 2-Butenedioic acid. pubchem.ncbi.nlm.nih.gov. [2024-05-11]. (原始内容存档于2024-06-10) (英语).
外部链接
[编辑]




